Воду ми використовуємо скрізь: басейни, ванна, опалення, приготування їжі… Ні для кого не секрет, що вода з часом забруднюється, так що ж робити? Тут на допомогу нам прийдуть елементи таблиці Менделєєва з допомогою яких можна виконати хімічну очистку води. У хімічній очистці води можуть бути використані багато речовини. Нижче представлені популярні хімічні реагенти, використовувані для очищення води.
Альгіциди

Альгіциди це хімічні сполуки, які при додаванні в воду вбивають сині і зелені водорості. Приклади таких сполук:
- сульфат міді,
- солі заліза,
- солі аміну і хлорид «бензалконію».
Альгіциди дуже ефективні в боротьбі з водоростями, але вони не дуже корисні проти «цвітіння» водоростей в навколишньому середовищі.
Зверніть увагу! Проблема альгіцідов полягає в тому, що вони вбивають всі присутні водорості, але не нейтралізують їх токсини, які звільняються цими водоростями до їх знищення.
Засоби проти спінювання
Піна-це маса бульбашок, що утворюються коли певні типи газів розсіюються в рідині. Утворення піни це складна тема досліджень у фізичній хімії, але відомо, що її присутність викликає серйозні проблеми в ході промислових процесів і якості готової продукції. Коли утворення піни не під контролем, вона може зменшити здатність роботи обладнання.
Суміш засоби проти утворення піни містить олії, в поєднанні з невеликою кількістю кремнезему. Ці сполуки розбивають піну завдяки двом властивостям кремнезему: несумісність з водною системою і легкість поширення. Засоби проти спінювання доступні або у вигляді порошку або у вигляді емульсії чистого продукту.
Порошок

Порошкоподібні засоби проти спінювання-це група продуктів на основі модифікованого полидиметилсилоксана. Ці продукти відрізняються між собою основними характеристиками, але як група дуже добре перешкоджають утворенню піни в широкому діапазоні застосувань і умов.
Засоби проти спінювання є хімічно інертними і не реагують з середовищем. Не мають запаху, смаку, не є летючими або токсичними і не викликають корозії матеріалів. Єдиний недолік подрібненого продукту є те, що він не може бути використаний у водному розчині.
Емульсії
Емульсії, тобто засоби проти спінювання -це полідиметилсилоксан в рідкому вигляді. Вони мають ті ж властивості, що і у формі порошку. Єдина різниця полягає в тому, що вони можуть бути застосовані у водних розчинах.
Коагулянти

Що стосується коагулянтів, переважними є позитивні іони з високою валентністю. Зазвичай іони алюмінію і заліза використовуються у вигляді Al2(SO4)3- («aluin») і заліза у вигляді FeCl3 або Fe2(SO4)3. Можна застосувати і відносно дешеву форму FeSO4, при умові, що вона буде змішана з перекисом водню і Fe3+ при аерації.
Коагуляція в значній мірі залежить від дози коагулянтів, pH і концентрації колоїдів. Щоб відрегулювати рН Ca (OH) 2 також використовується як флокулянта. Дози зазвичай знаходяться в діапазоні між 10 та 90 мг Fe3+/ L.
Інгібітори корозії

Корозія-це загальний термін, що визначає перехід металу в розчинну форму.
Корозія може призвести до руйнування важливих елементів системи котла, осадження продуктів корозії у відповідних поверхнях теплообмінників, і загального зниження продуктивності систем.
Тому інгібітори корозії часто використовуються у водяних опалювальних системах. Ці хімічні сполуки реагують з металевою поверхнею, даючи їй певний рівень захисту. Інгібітори часто діють шляхом адсорбції на металевій поверхні, захищаючи її, формуючи захисний шар на внутрішній стороні трубопроводів.
Існує п’ять різних видів інгібіторів корозії. Це:
- Пасивні інгібітори(«passivators»). Вони викликають зсув потенціалу корозії. Прикладами таких інгібіторів є окислюють аніони, такі як хромат, нітрит і нітрат, і іони не підтримують горіння, наприклад, фосфату і молібдату. Ці інгібітори є найбільш ефективними у зв’язку з чим найбільш поширені у використанні.
- Катодні інгібітори. Деякі з них, такі як сполуки миш’яку і сурми, працюють шляхом перешкоджання рекомбінації і вивільнення водню. Інші іони, такі як кальцій, цинк або магній, можуть бути обложені як оксиди, утворюючи захисний шар на металевій поверхні.
- Органічні Інгібітори. Вони впливають на всю поверхню корозійно-агресивних рідин металів, коли вони присутні у відповідній концентрації. Органічні інгібітори захищають метали шляхом створення плівки (шару) і гідрофобної групи на її поверхні.
- Інгібітори викликають опади. Це сполуки, що викликають утворення продукту осадження на металевій поверхні, таким чином створюючи захисну плівку. Найпопулярніші інгібітори цієї категорії це силікати і фосфати.
- Леткі інгібітори корозії (VCI). Ці сполуки проводять в закритому середовищі корозії випаровування з джерела. Прикладами таких інгібіторів є морфолин, гідразин і тверді леткі речовини, такі як солі дициклогексиламина, циклогексиламин і гексаметилен. При контакті з поверхнею металу, пар цих солей конденсується і гідролізує з допомогою вологи, щоб звільнити захисні іони.
Дезінфікуючі засоби
Дезинфікуючі засоби вбивають небажані мікроорганізми присутні у воді. Є багато різних типів дезінфікуючих засобів:
- Хлор (доза 2-10 мг / л);
- Діоксид хлору;
- Озон;
- Гіпохлорит.
Дезінфекція хлором діоксиду

ClO2 використовується в якості первинного дезинфікуючого засобу для поверхневих вод з проблемами запаху і смаку. Цей хлор містить біоцид в таких низьких концентраціях, як 0,1 частин на мільйон, і в широкому діапазоні рН. ClO 2 проникає через клітинну стінку і вступає в реакцію з амінокислотами в цитоплазмі клітини, щоб убити мікроорганізми.
Діоксид хлору дезінфікує у відповідності з тим же принципом як хлор. Тим не менш, на відміну від хлору, діоксид хлору не чинить шкідливого впливу на здоров’я людини.
Гіпохлорит

Гіпохлорит використовується таким же чином, як двоокис хлору і хлор. Гіпо-хлорування є способом дезінфекції, який останнім часом широко не використовується, оскільки доведено, що при дезінфекції, у воді з’являється консистенція бромат.
Знезараження озоном
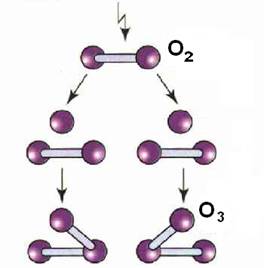
Озон є потужною окислювальним середовищем, з напрочуд короткою «життям». Він складається з частинок з додатковим атомом кисню з утворенням O3. Коли озон вступає в контакт з причиною запаху, бактеріями або вірусами додатковий Про-атом розбиває їх в процесі окислення. Додаткова молекула кисню настільки «изношевается», що в кінцевому результаті залишається тільки кисень.
Дезінфікуючі засоби можуть бути використані в багатьох галузях промисловості. Озон використовується в фармацевтичній промисловості для приготування питної води, при обробці води для різних процесів у виробництві надчистої води, а також для дезинфекції поверхонь.
Діоксид хлору використовується в першу чергу для підготовки питної води та дезінфекції трубопроводів.
Флоккулянты

Сприяють формуванню пластівців у воді, які містять зважені тверді частинки полімеру флоккулянтов (поліелектролітів). Вони сприяють утворенню зв’язків між молекулами. Ці полімери мають дуже специфічний ефект, в залежності від їх заряду, молекулярної маси і ступеня молекулярного розгалуження.
Полімери розчиняються у воді, і їх молекулярна маса складає від 10,5 до 10,6 г / л. При цьому можуть бути різні витрати одного флоккулянта. Катіонні полімери засновані на азоті, і аніонні полімери на основі карбонових кислот і цвиттерионов несуть як позитивні так і негативні іони.
Нейтралізуючі агенти (контроль лужності)

Для того щоб нейтралізувати кислоту використовується гідроксид натрію (NaOH), карбонат кальцію або вапно (Са (ОН) 2) для підвищення рН. Для зниження рН використовується розбавлена сірчана кислота (H 2 SO 4) або розведена соляна кислота (HCl). Доза нейтралізуючих агентів залежить від рН води в реакційному резервуарі. Нейтралізація реакції викликає підвищення температури.
Окислювачі
Хімічні окислювальні процеси вимагають використання (хімічних) окислювачів, щоб знизити рівень ГПК / БПК, а також для видалення органічних і неорганічних компонентів окислення.
Є багато окислюючих сполук. Приклади включають в себе:
- Пероксид водню;
- Озон;
- Поєднання озону і перекису;
- Кисень.
Пероксид водню

Широко використовується завдяки своїм властивостям. Це безпечний, ефективний, потужний і універсальний окислювач. Основне застосування H 2 O 2 є окислення для контролю запаху і корозії, окислення, органічного окислення металів і токсичних сполук. Найбільш важке окислення може зажадати активацію H 2 O 2 з використанням каталізатора, такого як залізо, мідь, марганець, або інших сполук металів.
Озон

Озон не застосовують тільки в якості дезинфікуючого засобу. Він може також полегшити видалення забруднень з води за допомогою окислення. Озон очищає воду, розбиваючи органічні забруднювачі і перетворення неорганічних забруднень у нерозчинну форму, які потім можуть бути зібрані на фільтрі. Озон може видалити до 25 видів забруднення.
З’єднання які можуть бути окислені озоном є:
- Розсмоктуються органічні галогени;
- Нітрит;
- Марганець;
- Ціаніди;
- Пестициди;
- Оксиди азоту;
- Речовини, які можуть викликати неприємний запах;
- Хлоровані вуглеводні;
- Пполихлорированные біфеніли.
Кисень

Кисень також може бути використаний в якості окислювача. В основному для окислення заліза і марганцю . Реакції, які відбуваються в процесі окислення киснем, як правило схожі.
Формули реакції окислення заліза і марганцю з киснем:
- 2 Fe 2+ + O 2 + 2 -> Fe 2 O 3 + H 2 O;
- 2 Мп 2+ + O 2 + 4 -> 2 MnO 2 + 2 H 2 O.








