Воду мы используем везде: бассейны, ванна, отопления, приготовления пище… Ни для кого не секрет что вода со временем загрязняется, так что же делать? Тут на помощь нам придут элементы из таблицы Менделеева с помощью которых можно выполнить химическую очистку воды. В химической очистке воды могут быть использованы многие вещества. Ниже представлены популярные химические реагенты используемые для очистки воды.
Альгициды
Альгициды это химические соединения, которые при добавлении в воду убивают синие и зеленые водоросли. Примеры таких соединений:
- сульфат меди,
- соли железа,
- соли амина и хлорид «бензалкония».
Альгициды очень эффективны в борьбе с водорослями, но они не очень полезны против «цветения» водорослей в окружающей среде.
Обратите внимание! Проблема альгицидов заключается в том, что убивают они все присутствующие водоросли, но не нейтрализуют их токсины, освобождаемые этими водорослями до их уничтожения.
Средства против вспенивания
Пена-это масса пузырьков, образующихся когда определенные типы газов рассеиваются в жидкости. Образование пены это сложная тема исследований в физической химии, но известно, что ее присутствие вызывает серьезные проблемы в ходе промышленных процессов и качества готовой продукции. Когда образование пены не под контролем, она может уменьшить способность работы оборудования.
Смесь средства против образования пены содержит масла, в сочетании с небольшим количеством кремнезема. Эти соединения разбивают пену благодаря двум свойствам кремнезема: несовместимость с водной системой и легкость распространения. Средства против вспенивания доступны либо в виде порошка либо в виде эмульсии чистого продукта.
Порошок
Порошкообразные средства против вспенивания-это группа продуктов на основе модифицированного полидиметилсилоксана. Эти продукты отличаются между собой основными характеристиками, но как группа очень хорошо препятствуют образованию пены в широком диапазоне применений и условий.
Средства против вспенивания являются химически инертными и не реагируют со средой. Не имеют запаха, вкуса, не являются летучими или токсичными и не вызывают коррозии материалов. Единственный недостаток измельченного продукта является то, что он не может быть использован в водном растворе.
Эмульсии
Эмульсии, т.е. средства против вспенивания -это полидиметилсилоксан в жидком виде. Они имеют те же свойства, что и в форме порошка. Единственная разница заключается в том, что они могут быть применены в водных растворах.
Коагулянты
Что касается коагулянтов, предпочтительными являются положительные ионы с высокой валентностью. Обычно ионы алюминия и железа используются в виде Al2(SO4)3- («aluin») и железа в виде FeCl3 или Fe2(SO4)3. Можно применить и относительно дешевую форму FeSO4, при условии что она будет смешана с перекисью водорода и Fe3+ при аэрации.
Коагуляция в значительной степени зависит от дозы коагулянтов, pH и концентрации коллоидов. Чтобы отрегулировать рН Ca (OH) 2 также используется в качестве флокулянта. Дозы обычно находятся в диапазоне между 10 и 90 мг Fe3+/ L.
Ингибиторы коррозии
Коррозия-это общий термин, определяющий переход металла в растворимую форму.
Коррозия может привести к разрушению важных элементов системы котла, осаждению продуктов коррозии в соответствующих поверхностях теплообменников, и общему снижению производительности систем.
Поэтому ингибиторы коррозии часто используются в водяных отопительных системах. Эти химические соединения реагируют с металлической поверхностью, давая ей определенный уровень защиты. Ингибиторы часто действуют путем адсорбции на металлической поверхности, защищая ее- формируя защитный слой на внутренней стороне трубопроводов.
Существует пять различных видов ингибиторов коррозии. Это:
- Пассивные ингибиторы(«passivators»). Они вызывают сдвиг потенциала коррозии. Примерами таких ингибиторов являются окисляющие анионы, такие как хромат, нитрит и нитрат, и ионы не поддерживающие горения, например, фосфата и молибдата. Эти ингибиторы являются наиболее эффективными в связи с чем наиболее распространены в использовании.
- Катодные ингибиторы. Некоторые из них, такие как соединения мышьяка и сурьмы, работают путем препятствования рекомбинации и высвобождения водорода. Другие ионы, такие как кальций, цинк или магний, могут быть осажденные как оксиды, образуя защитный слой на металлической поверхности.
- Органические Ингибиторы. Они влияют на всю поверхность коррозионно-агрессивных жидкостей металлов, когда они присутствуют в соответствующей концентрации. Органические ингибиторы защищают металлы путем создания пленки (слоя) и гидрофобной группы на ее поверхности.
- Ингибиторы вызывающие осадки. Это соединения, вызывающие образование продукта осаждения на металлической поверхности, таким образом создавая защитную пленку. Самые популярные ингибиторы из этой категории это силикаты и фосфаты.
- Летучие ингибиторы коррозии (VCI). Эти соединения проводят в закрытой среде коррозии улетучивания из источника. Примерами таких ингибиторов являются морфолин, гидразин и летучие твердые вещества, такие как соли дициклогексиламина, циклогексиламин и гексаметилен. При контакте с поверхностью металла, пар этих солей конденсируется и гидролизует с помощью влаги, чтобы освободить защитные ионы.
Дезинфицирующие средства
Дезинфицирующие средства убивают нежелательные микроорганизмы присутствующие в воде. Есть много различных типов дезинфицирующих средств:
- Хлор (доза 2-10 мг / л);
- Диоксид хлора;
- Озон;
- Гипохлорит.
Дезинфекция хлором диоксида
ClO2 используется в качестве первичного дезинфицирующего средства для поверхностных вод с проблемами запаха и вкуса. Этот хлор содержит биоцид в таких низких концентрациях, как 0,1 частей на миллион, и в широком диапазоне рН. ClO 2 проникает через клеточную стенку и вступает в реакцию с аминокислотами в цитоплазме клетки, чтобы убить микроорганизмы.
Диоксид хлора дезинфицирует в соответствии с тем же принципом как хлор. Тем не менее, в отличие от хлора, диоксид хлора не оказывает вредного воздействия на здоровье человека.
Гипохлорит
Гипохлорит используется таким же образом, как двуокись хлора и хлор. Гипо-хлорирование является способом дезинфекции, который в последнее время широко не используется, поскольку доказано что при дезинфекции, в воде появляется консистенция бромата.
Обеззараживание озоном
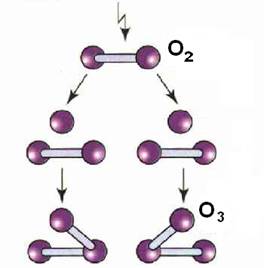
Озон является мощной окислительной средой, с удивительно короткой «жизнью». Он состоит из частиц с дополнительным атомом кислорода с образованием O3. Когда озон вступает в контакт с причиной запаха, бактериями или вирусами дополнительный О-атом разбивает их в процессе окисления. Дополнительная молекула кислорода настолько «изношевается», что в конечном результате остается только кислород.
Дезинфицирующие средства могут быть использованы во многих отраслях промышленности. Озон используется в фармацевтической промышленности для приготовления питьевой воды, при обработке воды для различных процессов в производстве сверхчистой воды, а также для дезинфекции поверхностей.
Диоксид хлора используется в первую очередь для подготовки питьевой воды и дезинфекции трубопроводов.
Флоккулянты
Способствуют формированию хлопьев в воде, которые содержат взвешенные твердые частицы полимера флоккулянтов (полиэлектролитов). Они способствуют образованию связей между молекулами. Эти полимеры имеют очень специфический эффект, в зависимости от их заряда, молекулярной массы и степени молекулярного ветвления.
Полимеры растворимы в воде, и их молекулярная масса составляет от 10,5 до 10,6 г / л. При этом могут быть несколько разные расходы одного флоккулянта. Катионные полимеры основанные на азоте, и анионные полимеры на основе карбоновых кислот и цвиттерионов несут как положительные так и отрицательные ионы.
Нейтрализующие агенты (контроль щелочности)
Для того чтобы нейтрализовать кислоту используется гидроксид натрия (NaOH), карбонат кальция или известь (Са (ОН) 2) для повышения рН. Для снижения рН используется разбавленная серная кислота (H 2 SO 4) или разбавленная соляная кислота (HCl). Доза нейтрализующих агентов зависит от рН воды в реакционном резервуаре. Нейтрализация реакции вызывает повышение температуры.
Окислители
Химические окислительные процессы требуют использования (химических) окислителей, чтобы снизить уровень ХПК / БПК, а также для удаления органических и неорганических компонентов окисления.
Есть много окисляющих соединений. Примеры включают в себя:
- Пероксид водорода;
- Озон;
- Сочетание озона и перекиси;
- Кислород.
Пероксид водорода
Широко используется благодаря своим свойствам. Это безопасный, эффективный, мощный и универсальный окислитель. Основное применение H 2 O 2 являются окисление для контроля запаха и коррозии, окисления, органического окисления металлов и токсичных соединений. Наиболее трудное окисление может потребовать активацию H 2 O 2 с использованием катализатора, такого как железо, медь, марганец, или других соединений металлов.
Озон
Озон не применяют только в качестве дезинфицирующего средства. Он может также облегчить удаление загрязнений из воды посредством окисления. Озон очищает воду, разбивая органические загрязнители и преобразования неорганических загрязнений в нерастворимую форму, которые затем могут быть собраны на фильтре. Озон может удалить до 25 видов загрязнения.
Соединения которые могут быть окислены озоном являются:
- Рассасывающиеся органические галогены;
- Нитрит;
- Марганец;
- Цианиды;
- Пестициды;
- Оксиды азота;
- Вещества, которые могут вызвать неприятный запах;
- Хлорированные углеводороды;
- Пполихлорированные бифенилы.
Кислород
Кислород также может быть использован в качестве окислителя. В основном для окисления железа и марганца . Реакции которые происходят в процессе окисления кислородом, как правило похожи.
Формулы реакции окисления железа и марганца с кислородом:
- 2 Fe 2+ + O 2 + 2 ОН — -> Fe 2 O 3 + H 2 O;
- 2 Мn 2+ + O 2 + 4 ОН — -> 2 MnO 2 + 2 H 2 O.